Perclorato de litio
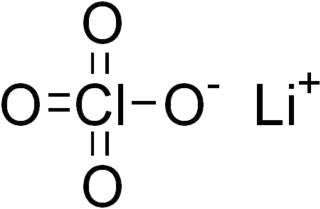
El perclorato de litio es un compuesto inorgánico con fórmula LiClO4. Es una sal blanca o incolora que destaca por su alta solubilidad en la mayoría de disolventes. Existe tanto en forma anhidra y como en trihidrato.
| Perclorato de Litio | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Perclorato de Litio | ||
| General | ||
| Otros nombres | sal de litio, ácido perclórico | |
| Fórmula semidesarrollada | LiClO4 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 7791-03-9[1] | |
| ChEMBL | CHEMBL3613684 | |
| ChemSpider | 133514 | |
| PubChem | 23665649 | |
| Propiedades físicas | ||
| Apariencia | Cristales blancos | |
| Masa molar | 106 392 g/mol | |
| Punto de fusión | 236 °C (509 K) | |
| Punto de ebullición | 430 °C (703 K) | |
| Propiedades químicas | ||
| Solubilidad en agua | 60 g/100 mL | |
| Peligrosidad | ||
| NFPA 704 |
0
2
0
OX
| |
| Riesgos | ||
| Riesgos principales | Oxidante, irritante | |
| Compuestos relacionados | ||
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Producción
Puede ser producido mediante la reacción del perclorato de sodio con cloruro de litio. También puede ser obtenido por electrólisis de clorato de litio a 200 mA/cm² a temperatura superior de 20 °C.[2]
Seguridad
Los percloratos pueden producir explosiones mezclados con compuestos orgánicos.[2]
Véase también
Referencias
- Número CAS
- Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone "Chlorine Oxides and Chlorine Oxygen Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. doi 10.1002/14356007.a06_483
Enlaces externos
Este artículo ha sido escrito por Wikipedia. El texto está disponible bajo la licencia Creative Commons - Atribución - CompartirIgual. Pueden aplicarse cláusulas adicionales a los archivos multimedia.
