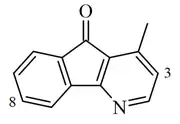
Oniquina
La oniquina es un alcaloide aislado de la madera del árbol Onychopetalum amazonicum y Guatteria dielsiana, y de la corteza de Cleistopholis patens (Annonaceae). Este compuesto muestra actividad antifúngica contra Candida.[2] UV: [neutral]λmax253 (log ε4.62) ;279 (log ε3.85) ;289 (log ε3.88) ;308 (log ε3.3) (EtOH). Este compuesto fue aislado por primera vez por en . Se estableció una fórmula errónea como 4-metil-1-azafluorenona por muchos años hasta que fue se volvió a aislar y se estableció la estructura correcta.
| Oniquina | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| 4-Metil-5H-indeno[1,2-b]piridin-5-ona. 1-Metil-4-azafluorenona. | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular | C13H9NO | |
| Identificadores | ||
| Número CAS | 58787-04-5[1] | |
| PubChem | 72584 | |
| Propiedades físicas | ||
| Apariencia | Agujas amarillo pálido (EtAcO/éter de petróleo) | |
| Masa molar | 195,22 g/mol | |
| Punto de fusión | 137 °C (410 K) | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Derivados
| Nombre | Derivado | Fórmula molecular | CAS | Masa molecular (g/mol) | Estado | Fuente natural | Otras propiedades |
|---|---|---|---|---|---|---|---|
| 3-Hidroxioniquina | 3-Hidroxi | C13H9NO2 | 942472-64-2 | 211.220 | Polvo amarillo amorfo | Aislado de Polyalthia nemoralis[3] | UV: [neutral]λmax214 (log ε3.99) ;249 (log ε4.1) ;269 (log ε4.12) ( MeOH) |
| Oxilopinina | 8-Hidroxi | C13H9NO2 | 211.220 | Agujas amarillas PF = 244 | Aislado de Oxandra xylopioides (Annonaceae) y Unonopsis spectabilis (Annonaceae). | ||
| 6-Metoxioniquina | 6-metoxi | C14H11NO2 | 105418-67-5 | 225.246 | Cristales (EtOH) PF = 95 - 98 °C | Aislado de la madera de Guatteria dielsiana[4] | UV: [neutral]λmax252 (log ε4.22) ;280 (log ε3.79) ;292 (log ε3.75) ;312 (log ε3.43) (EtOH)[3] |
Síntesis
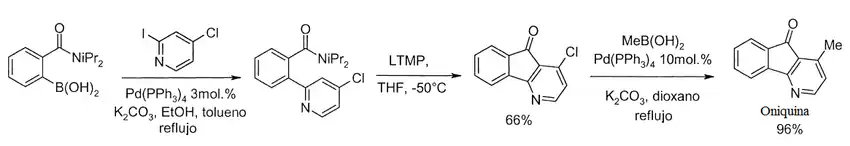
Rebstock y colaboradores sintetizaron la oniquina a partir de ácido [2-(diprop-1-en-2-ilcarbamoil)fenil]borónico y 4-cloro-2-yodopiridina de acuerdo al siguiente esquema sintético:[5]
- a)Ambos precursores se ponen a reaccionar con un catalizador de paladio de acuerdo al procedimiento de la reacción de Suzuki.
- b)En presencia de una base (2,2,6,6-tetrametilpiperiduro de litio) se logra la ciclización para formar el anillo de azaindeno.
- c)Se lleva a cabo una metilación de acuerdo a la reacción de Suzuki
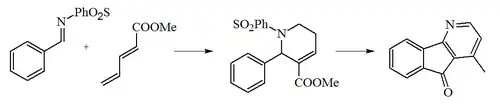
Clary y colaboradores sintetizaron la oniquina a través de una reacción de aza-Morita-Baylis-Hillman utilizando N-(bencilideno)bencensulfonamida con 2,4-pentadienoato de metilo, seguido por una adición conjugada intramolecular, una acilación de Friedel-Crafts , una adición de metilo por acción del metilcuprato y formación del anillo aromático.[6]
Referencias
- Número CAS
- Hufford, C.D. et al., J. Nat. Prod., 1987, 50, 961- 964
- Zhang, J. et al., J. Nat. Prod., 1987, 50, 800- 806
- Goulart, M.O.F. et al., Phytochemistry, 1986, 25, 1691- 1695
- Rebstock et al. Tetrahedron 60 (2004) 2181–2186
- Clary et al. Synlett 2010(18): 2802-2804