Metilmalonil-CoA descarboxilasa
La metilmalonil-CoA descarboxilasa (EC 4.1.1.41) es una enzima que cataliza la descarboxilación del metilmalonato a propanoato y dióxido de carbono. Requiere como cofactor biotina.[1]
- S-metilmalonil-CoA Propanoil-CoA + CO2
| Metilmalonil-CoA descarboxilasa | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 4.1.1.41 | |||
| Estructura/Función proteica | ||||
| Tipo de proteína | Liasa | |||
| Funciones | Enzima | |||
| Ortólogos | ||||
| Especies |
| |||
| Ubicación (UCSC) |
| |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
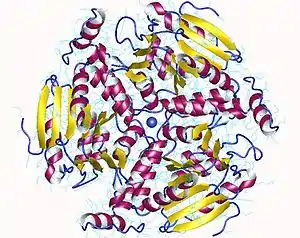
Metilmalonil-CoA descarboxilasa trimer, E.Coli.
La enzima de la Veillonella alcalescens es una biotinil-proteína que requiere sodio y actúa como una bomba de sodio.[1] La enzima de la Escherichia coli se presenta como dímero de homotrímeros.[2]
Referencias
- «ENZYME entry: EC 4.1.1.41». Consultado el 27 de noviembre de 2011.
- «Methylmalonyl-CoA decarboxylase». Consultado el 27 de noviembre de 2011.
Este artículo ha sido escrito por Wikipedia. El texto está disponible bajo la licencia Creative Commons - Atribución - CompartirIgual. Pueden aplicarse cláusulas adicionales a los archivos multimedia.