Mandelonitrilo
El mandelonitrilo es un compuesto orgánico. Según la nomenclatura química se puede definir, bien como el nitrilo del ácido mandélico, o como la cianohidrina del benzaldehído. Es quiral, pero solo el isómero (R)-(+) se produce de forma natural.
| Mandelonitrilo | ||
|---|---|---|
-Mandelonitrile-3D-balls.png.webp) | ||
| General | ||
| Otros nombres |
2-hidroxi-2-fenilacetonitrilo, α-hidroxibencenoacetonitrilo | |
| Fórmula estructural |
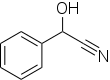 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 532-28-5[1] | |
| ChEBI | 16910 | |
| ChEMBL | CHEMBL1393845 | |
| ChemSpider | 10304 | |
| PubChem | 10758 | |
| UNII | 584322E08A | |
| KEGG | C00561 | |
| Propiedades físicas | ||
| Masa molar | 133,052764 g/mol | |
Es la parte aglicona de los glucósidos cianogénicos prunasina y amigdalina, y se encuentra de forma natural en las semillas de algunos frutales, procedente de la descomposición de aquellos.
Se puede descomponer en cianuro y benzaldehído, una reacción que puede ser catalizada por la enzima mandelonitrilo liasa.
Propiedades
A temperatura ambiente, el mandelonitrilo es un líquido amarillo. Su punto de fusión es -10 °C. Es combustible, difícilmente inflamable, y su temperatura de ignición es 86 °C. Es muy poco soluble en agua, soluble en etanol, tricloroetano y éter dietílico. Se descompone si se calienta por encima de 170 °C.[2]
Usos
El enantiómero (R)-(+) se utiliza en síntesis industrial como intermediario en la preparación de varios compuestos ópticamente activos, como los ácidos α-hidroxicarboxílicos, α-hidroxialdehídos, α-hidroxicetonas y 2-aminoalcoholes.[3]
Obtención en laboratorio
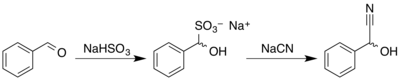
El mandelonitrilo se sintetiza de forma similar a otras cianohidrinas. En una reacción de un solo recipiente, el benzaldehído se hace reaccionar con bisulfito de sodio, y el aducto resultante reacciona a continuación con una solución de cianuro de sodio o de potasio.[4] El producto se obtiene como mezcla racémica.
Referencias
- Número CAS
- «GESTIS Substance database». gestis-en.itrust.de. Archivado desde el original el 11 de noviembre de 2016. Consultado el 11 de octubre de 2020.
- Kruse, C.G. In Collins, A.N. Sheldrake, G.N. Crosby, J., Eds. Chirality in Industry Chichester, UK, (1992), 279
- Corson, B. B.; Dodge, R. A.; Harris, S. A.; Yeaw, J. S. (1941). "Mandelic Acid". Org. Synth.; Coll. Vol. 1: 336.