Ácido nitroso
El ácido nitroso es un compuesto químico y un ácido inorgánico monoprótico que se encuentra sólo en solución[4] y en sus sales, los nitritos.
| ácido nitroso | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| ácido dioxonítrico(III) | ||
| General | ||
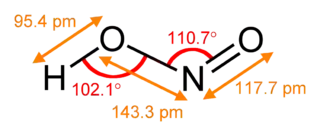
| Fórmula estructural | imagen superior | |
| Fórmula molecular | HNO2 | |
| Identificadores | ||
| Número CAS | 7782-77-6[1] | |
| ChEBI | 25567 | |
| ChEMBL | CHEMBL1161681 | |
| ChemSpider | 22936 | |
| DrugBank | 09112 | |
| PubChem | 24529 | |
| UNII | T2I5UM75DN | |
| KEGG | C00088 | |
| Propiedades físicas | ||
| Densidad | 1000 kg/m³; 1 g/cm³ | |
| Masa molar | 470 134 g/mol | |
| Propiedades químicas | ||
| Acidez | 3.16,[2] 3.25[3] pKa | |
| Solubilidad en agua | Depende de la disolución | |
| Peligrosidad | ||
| NFPA 704 |
0
4
2
| |
| Riesgos | ||
| Piel | Puede causar cambios mutagénicos en seres vivos | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido nitroso se emplea para convertir aminas en diazocompuestos y sal de diazonio. Se trata de un agente mutágeno que provoca la desaminación oxidativa de la adenina y la citosina, originando transiciones. Así, el ácido nitroso causa el desprendimiento de nitrógeno de las aminas alifáticas primarias y con las aminas secundarias reacciona para formar nitrosaminas. En cambio, en las aminas terciarias, tanto las alifáticas como las aromáticas, no hay una reacción especial salvo la reacción ácido-base para formar un nitrito, el cual, al calentar la disolución, se decompone.[5]
Síntesis
Puede obtenerse agregándole un ácido mineral (como el sulfúrico) al nitrito de sodio.
Descomposición
El ácido nitroso es bastante inestable, y se descompone rápidamente a óxido de nitrógeno (lV), óxido de nitrógeno (II) y agua cuando se encuentra en solución:
- 2 HNO2 → NO2 + NO + H2O
También se puede descomponer en ácido nítrico, óxido de nitrógeno (I) y agua:
- 4 HNO2 → 2 HNO3 + N2O + H2O
Referencias
- Número CAS
- DOI:https://doi.org/10.1021/jp0639243
- 2016-2017. Haynes W. M. (editor). Handbook of chemistry and physics, 97 th edition. CRC press. ISBN 978-1-4987-5429-3
- Angiolani, Argeo (1960). Introducción a la química industrial: fundamentos químicos y tecnológicos. Andrés Bello. Consultado el 28 de enero de 2018.
- Teijón, José María y José Antonio García Pérez (1996).Química: Teoría y problemas, pág. 399. Editorial Tebar. En Google Books. Consultado el 27 de enero de 2016.
