Ácido cloroacético
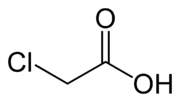
El Ácido cloroacético es el compuesto químico con la fórmula ClCH2CO2H. Este ácido carboxílico es un útil "bloque de construcción" en síntesis orgánica. Como otros ácidos cloroacéticos y halocarbonos relacionados, es un potencialmente peligroso agente de alquilación.
| Ácido cloroacético | ||
|---|---|---|
  | ||
| Nombre IUPAC | ||
| Ácido Cloroacético | ||
| General | ||
| Fórmula semidesarrollada | ClCH2CO2H | |
| Fórmula molecular | C2H3ClO2 | |
| Identificadores | ||
| Número CAS | 79-11-8[1] | |
| ChEBI | 27869 | |
| ChEMBL | CHEMBL14090 | |
| ChemSpider | 10772140 | |
| UNII | 5GD84Y125G | |
| KEGG | C06755 D07677, C06755 | |
| Propiedades físicas | ||
| Apariencia | Cristales incoloros o blancos | |
| Densidad | 1580 kg/m³; 1,58 g/cm³ | |
| Masa molar | 94,5 g/mol | |
| Punto de fusión | 336 K (63 °C) | |
| Punto de ebullición | 456 K (183 °C) | |
| Propiedades químicas | ||
| Acidez | 2.82 pKa | |
| Solubilidad en agua | soluble | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Producción
El Ácido cloroacético es sintetizado por cloración de ácido acético en la presencia de fósforo rojo, azufre, o yodo como catalizador:
- CH3CO2H + Cl2 → ClCH2CO2H + HCl
También se forma por la hidrólisis de tricloroetileno usando ácido sulfúrico como catalizador.
También es obtenido por la cloración del ácido acético a 85 °C bajo presión de 6 Bar con adición de cantidades catalíticas de anhídrido acético o cloruro de acilo.
Aplicaciones
El ácido cloroacético es la materia prima para la carboximetil celulosa, así como para agentes pesticidas, colorantes y fármacos. El ácido cloroacético es usado directamente en el tratamiento de verrugas (con el nombre comercial de Acetocaustin).
Es ilustrativo de su utilidad en química orgánica la O-alquilación de salicilaldeídos con ácido cloroacético, seguida por la decarboxilación del éter resultante, produciéndose benzofurano.[2]
Es utilizado en modificaciones del sílece, para aplicación en reacciones de epoxidación de olefinas y álcoholes insaturados.[3][4]
Referencias
- Número CAS
- Burgstahler, A. W.; Worden, L. R. (1966). "Coumarone." Org. Synth. 46: 28.
- «Lucas B. F. R. Cunha* (IC), Jocilene D. Torres (PG) y Alejandro G. S. Prado (PQ) - Síntesis y Caracterización del Sílece Modificado con Ácido Cloroacético - Instituto de Química, Universidad de Brasilia, C.P. 4478, 70904-970 Brasilia, DF, Brasil.». Archivado desde el original el 4 de marzo de 2016. Consultado el 15 de marzo de 2011.
- Clark, J. H. Acc. Chem. Res. 2001, 35, 791
Enlaces externos
- Ficha de Datos de Seguridad de assets.chemportals.merck.de (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- «Monochloroacetic Acid». Dow Chemical. (en inglés)
- «Monochloroacetic Acid». IPCS Inchem. (en inglés)